组织修复与再生,干细胞扮演着什么角色
组织修复与再生,干细胞扮演着什么角色
撰文:小明月
●●●
干细胞具有自我复制和多向分化潜能,能够再生人体的各种组织,因此在组织修复和再生中有一定的临床潜力,特别是在骨折愈合、软骨愈合及创伤后炎症等方面。
局部细胞和组织损伤后,机体对损伤所形成的缺损进行修补恢复的过程称修复。修复是机体抗损伤的表现,组织修复主要是通过再生来完成的。再生是体内细胞或组织损伤后,由邻近正常细胞分裂增殖来修补的过程。
虽然,干细胞治疗真正实现大规模临床应用之前,还有许多问题等待解决。

1 干细胞基础知识介绍
干细胞,简单来讲,它是一类具有多向分化潜能和自我复制能力的原始的未分化细胞,是形成各组织器官的原始细胞。干细胞微环境是干细胞赖以生存的基础,对调控干细胞命运具有重要的作用。干细胞是在全身的某个局部微环境(niche)中被发现的,在这个环境中干细胞处于未分化的休眠状态。
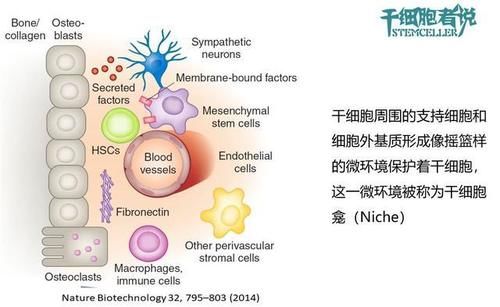
图. 骨髓造血微环境
在干细胞和邻近细胞之间存在多种分子机制控制着其分化和自我保护。本文主要介绍涉及创伤修复的四种细胞:间质干细胞(MSCs),造血干细胞(HSC),脂肪干细胞(ADSC)和内皮祖细胞(EPC)。其中MSC主要存在于结缔组织,HSC大部分主要存在于骨髓和血液中,EPC位于血管内皮,而ADSC存储于脂肪组织。
间质干细胞(MSCs)在中胚层内分化成非造血细胞,如成骨细胞、软骨细胞、脂肪细胞。间充质干细胞高表达CD105、CD73和CD90。MSCs是临床试验中研究最多的一类细胞。
造血干细胞(HSC)能够分化成为血液系统和免疫系统的细胞,表达CD34分子标记,可以从骨髓、外周血、脐带血中获得。造血干细胞是研究历史最长且最为深入的一类成体干细胞。
脂肪干细胞(ADSC)由脂肪组织中获得,除了表达间充质干细胞标志物,常常表达CD31-CD34+等分子标记。脂肪干细胞属于间充质干细胞的一种。
内皮祖细胞(EPC)具有血管生成的潜力,它们存在于外周循环中。
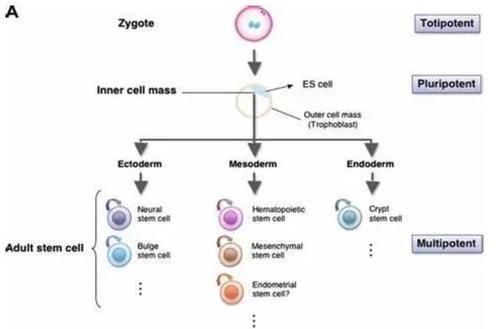
如何讲干细胞的潜能性才不会出错
2 干细胞与创伤修复
内源性干细胞对创伤的反应包括:从休眠状态中苏醒;从特定的干细胞巢(niche)动员;向受伤的部位迁移;分化产生特定细胞。此外,长期病理性炎性反应会导致干细胞的功能失调,使干细胞的数量减少,最终导致组织再生失败。
在创伤后,MSCs与HSC的迁移已被许多趋化作用阐明。其中一种信号途径就是SDF-1/CXCR4(基质衍生因子1/特异性趋化因子受体4)轴。这条信号轴解释了干细胞在局部停留及向受伤部位迁移的过程。
CXCR4是BMSCs的一种受体,它能结合SDF-1。SDF-1是一种由骨髓内皮细胞和基质细胞表达的蛋白质,继受伤后,SDF-1在组织损伤的部位产生,其浓度高于骨髓处,于是骨髓中MSCs向受伤部位转移。SDF-1的表达受缺氧诱导因子-1(HIF-1)和一氧化氮(NO)调控。
在正常生理情况下,骨髓中的SDF-1浓度稍高,有利于保留BMSCs。这在动物骨折和心肌损伤模型中已被证实, CXCR4 受体的上调也使得MSCs向SDF-1浓度高的地方迁移得到进一步加强。
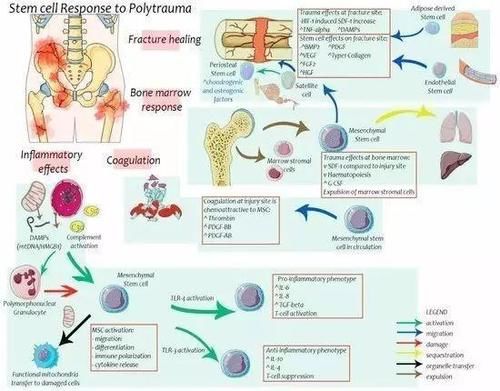
3 干细胞与骨折愈合
骨折会引起骨髓内间充质干细胞的增生,骨髓和骨膜内的驻留干细胞会迁移至损伤部位。因为在骨折处需要有一定数量的干细胞进行修复创伤,同时骨萎缩也被证实与骨折处缺乏干细胞有关。
恢复良好的血供是干细胞迁移并存活的必要条件。Atesok. K等发现:在小鼠骨折后进行纯化后的内皮祖细胞注射,有利于血管增生及更快的骨折愈合:在骨折部位EPC的血管生成效应与增加的亲血管生成因子hVEGF、hFGF2和hHGF 44的局部水平相关;同时还发现MSCs的迁移与增加的小鼠骨痂体积和强度有关联。MSCs约在EPC使用后第14天出现在骨折处。这些治疗效果与BMSCs迁移后局部BMP-21(骨形态生成蛋白)的表达有关。
在受伤后,干细胞对血管生成有直接和间接的影响。一些研究表明,EPC迁移到受伤的部位后直接参与了新生血管的形成。其他的研究也已经证实EPC通过生长因子、细胞因子的调节促进新生血管生成。
MSCs和ADSC也有促进血管生成的作用。这些血管生成功能最终有助于改善骨折的愈合、毛细血管再生、伤口的康复及减少炎症并发症。
